Science | 生命中心刘俊杰课题组开发基于RNA核酶的新型基因编辑工具
基因承载着遗传信息,定义了生命的多样性和复杂性。基因编辑是理解和改造生命的关键技术,在生物学研究和生物产业发展中发挥着重要作用。历代基因编辑工具,如巨核酸酶、ZFNs、TALENs均以蛋白质为基础,识别和切割DNA,编辑位点的重编程较为困难。目前被广泛使用的CRISPR-Cas工具,是RNA引导的蛋白核酸酶,通过引导RNA的间隔序列来识别DNA,具有很好的编辑位点重编程能力,但依然存在着PAM序列限制、分子量大、蛋白免疫原性等多种问题。2024年2月1日,生命中心、清华大学生命学院刘俊杰(Jun-Jie Gogo Liu)课题组在Science杂志在线发表了题为Hydrolytic endonucleolytic ribozyme (HYER) is programmable for sequence-specific DNA cleavage的研究论文,报道了一种催化性RNA(核酶)—HYER(水解型内切核酶)。HYER可序列特异地切割RNA和DNA底物,并对哺乳动物细胞基因组产生位点特异的编辑。无需蛋白核酸酶的参与,HYER的底物识别和切割均由RNA分子实现,有望成为继CRISPR之后,新一代的基因编辑底盘工具。

图1. 历代基因编辑工具 HYER源自细菌逆转座子(第二类内含子,GII intron ),一种可在宿主基因组上“拷贝和粘贴”(逆转座)的可移动元件。该元件通常编码一个兼具核酸酶和逆转录酶活性的蛋白质,以及一个RNA分子,通过形成蛋白核酸复合物(RNP)来执行在宿主基因组中的逆转座扩增。有趣的是,通过广泛的生物信息学筛选,刘俊杰(Jun-Jie Gogo Liu)课题组发现了许多不编码蛋白的、紧凑的二类C型内含子(ORF-less GII-C intron)在细菌基因组中存在多拷贝的现象。这一现象暗示,这些内含子编码的唯一组份,RNA分子,可能具有不依赖蛋白的扩增位点识别和切割能力,来实现内含子在宿主基因组内的拷贝扩增。
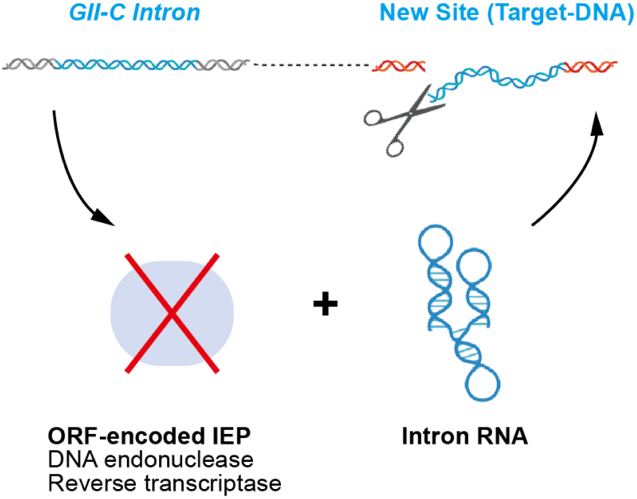
图2. 不含蛋白组分的第二类内含子RNA在基因组中“拷贝和粘贴”的假设示意图 生化实验表明,这些长度约600 nt的RNA分子在广谱的离子浓度和温度范围内,具有显著的RNA和DNA水解切割活性。因此,研究人员将这些RNA分子命名为水解型内切核酶(Hydrolytic Endonucleolytic Ribozymes, HYERs),这是科学界首次报道具有DNA水解切割能力的核酶(Ribozyme)。值得注意的是,HYER1和HYER2表现出了与紧凑型的CRISPR-Cas12e (CasX) 和Cas12l (Cas π)相当的DNA体外切割效率。为检验HYER在细胞内的DNA切割能力,研究人员在大肠杆菌中构建了ccdB毒蛋白报告系统,证明HYER1和HYER2可以对带有ccdB毒基因的质粒进行靶向切割。在HEK293T细胞内,研究人员构建了移码Puromycin抗性基因(puro*)报告系统。结果表明,HYER1可对puro*产生移码编辑,赋予细胞Puromycin抗性。在抗性筛选富集后的细胞里,三个靶位点中最高的编辑效率为9.18%。这表明,HYER可以在真核细胞基因组中引入双链断裂并产生编辑。然而,在未经Puromycin筛选富集的细胞中,编辑效率仅为0.09%到0.2%,表明HYER的真核基因编辑能力还有很大的进步和优化空间。

图3. HYER的DNA切割活性检验 研究人员利用冷冻电镜获得了HYER1的高分辨三维结构(3.0 Å),发现HYER1以同源二聚体的形式存在,并揭示HYER1水解切割DNA的机理。HYER1通过一段暴露的单链RNA (6 nt)区域,TRS (Target Recognition Site),识别并招募DNA底物,将DNA捕获在结构域V所形成的催化核心中,通过经典的双镁离子机制催化DNA水解。

图4. HYER1的电子密度图和DNA水解切割机制 基于HYER的三维结构,研究人员进行了多种理性设计,证明HYER具有良好的可编程性,可根据底物序列,灵活设计TRS的序列和长度;在TRS临近区域插入14 nt 的底物招募序列(Recruiting Sequence, RS),可明显提高HYER1的底物识别特异性和切割效率;对回文序列和TRS进行改造, HYER1则可形成带有两个不同TRS的异源二聚体,靶向双链DNA底物的不同区域,产生了具有5’突出、3’突出或平末端的定制化切割产物。

图5. 多种理性设计提高了HYER1的底物识别特异性和切割效率 有趣的是,受“RNA世界”假说的启发,研究人员提出了第二类内含子中的“RNA的催化功能逐渐被蛋白质取代”的分子进化历程:在进化过程中,第二类内含子的结构域IV逐渐扩大,并产生了可编码短肽的开放阅读框(ORF),而这些短肽可作为顺式元件与内含子RNA相互作用,增强其结构稳定性和催化活性;随着ORF变得更长,更为成熟,其编码的蛋白质不仅起到稳定结构的作用,亦获得了DNA切割和逆转录活性,以替代RNA核酶行使催化功能。该成果不仅拓展了科学界对“RNA世界”假说和RNA催化功能的理解,也为创制具有我国完全自主知识产权的新型核酸操纵底盘工具,用于基因编辑和RNA编辑等,奠定了基础。

图6. 第二类内含子的进化假想 生命中心PI刘俊杰为本文通讯作者;清华大学生命学院博士生刘子贤、高精尖结构中心卓越学者张寿悦博士、博士生朱汉舟、博士后陈之航、博士生杨韵和博士生李隆骐为该文共同第一作者;清华大学生命学院本科生刘云、博士生李丹苑、孙奥、李承平、谭顺青、王高立、沈婕怡、水木学者靳帅博士,中国科学院遗传与发育生物学研究所高彩霞研究员和博士生雷源为本研究做出了大力贡献。清华大学冷冻电镜平台为本研究提供了设备和技术支持。本研究得到了基金委原创项目(32150018)、农业部和清华大学的经费、资源支持。 生命中心刘俊杰课题组长期关注核酸酶机制研究及核酸操纵工具的开发、应用。综合运用生物信息学、结构生物学、生物化学和细胞生物学手段,刘俊杰课题组及合作者已鉴定并开发了多种基因编辑工具(Cell, 2023; Nature, 2019; Mol. Cell, 2022; Cell Res., 2023) 。课题组长期招募对新型核酸操纵系统挖掘和RNA生物学感兴趣,具有生物信息学、细胞生物学等学科背景的博士后。(实验室网页http://gogolab.life.tsinghua.edu.cn)。 参考文献 Deng, P., Tan, S.Q., Yang, Q.Y., Fu, L., Wu, Y., Zhu, H.Z., Sun, L., Bao, Z., Lin, Y., Zhang, Q.C., Wang, H., Wang, J., and Liu, J.J.G. (2023). Structural RNA components supervise the sequential DNA cleavage in R2 retrotransposon. Cell 186, 2865-2879. Liu, J.J., Orlova, N., Oakes, B.L., Ma, E., Spinner, H.B., Baney, K.L., Chuck, J., Tan, D., Knott, G.J., Harrington, L.B., Basem, A.S., Wagner, A., Brotzmann, J., Staahl, B.T., Taylor, K.L., Desmarais, J., Nogales, E., and Doudna, J.A. (2019). CasX enzymes comprise a distinct family of RNA-guided genome editors. Nature 566, 218-223. Tsuchida, C.A., Zhang, S., Doost, M.S., Zhao, Y., Wang, J., O’Brien, E., Fang, H., Li, C.P., Li, D., Hai, Z.Y., Chuck, J., Brotzmann, J., Vartoumian, A., Burstein, D., Chen, X.W., Nogales, E., Doudna, J.A., and Liu, J.J.G. (2022). Chimeric CRISPR-CasX enzymes and guide RNAs for improved genome editing activity. Molecular Cell 82, 1199-1209. e1196. Sun, A., Li, C.P., Chen, Z., Zhang, S., Li, D.Y., Yang, Y., Li, L.Q., Zhao, Y., Wang, K., Li, Z., Liu, J., Liu, S., Wang, J., and Liu, J.J.G. (2023). The compact Casπ (Cas12l) 'bracelet' provides a unique structural platform for DNA manipulation. Cell Research 33, 229-244. 原文链接:https://doi.org/10.1126/science.adh4859



