生命中心胡小玉课题组发现上皮间肥大细胞功能
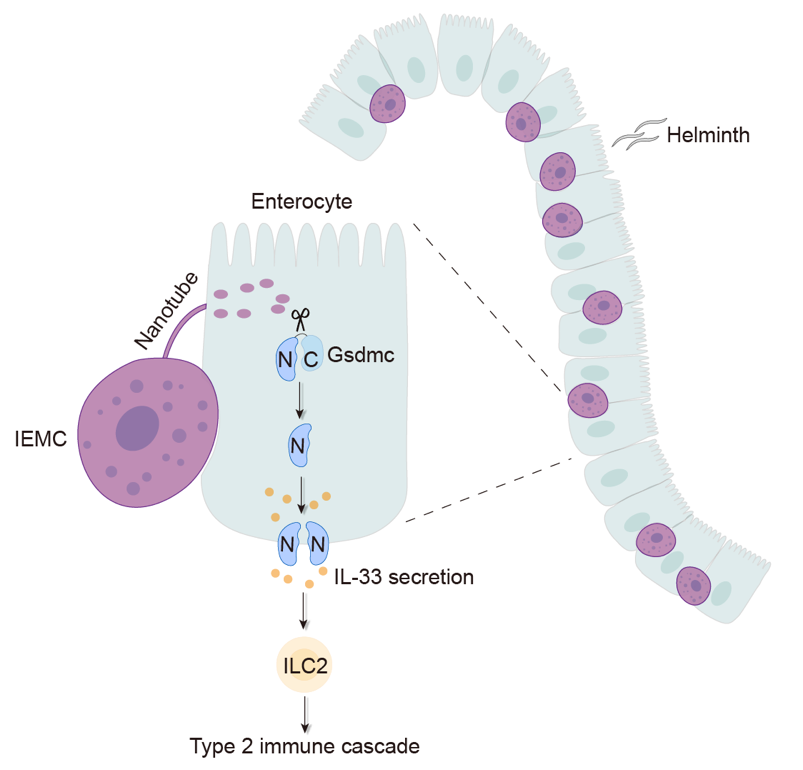
2024年4月12日,生命中心胡小玉课题组在《Immunity》杂志在线发表了题为““Intraepithelial mast cells drive gasdermin C-mediated type 2 immunity”的研究论文。该文章以定植于肠道上皮中的一类特殊肥大细胞群体为研究对象,揭示了这群肥大细胞在二型免疫反应中所起的重要作用,并阐述了这群肥大细胞与上皮细胞相互作用,激活上皮细胞中的Gasdermin C蛋白,从而介导二型免疫关键细胞因子IL-33分泌的多细胞互作链条。
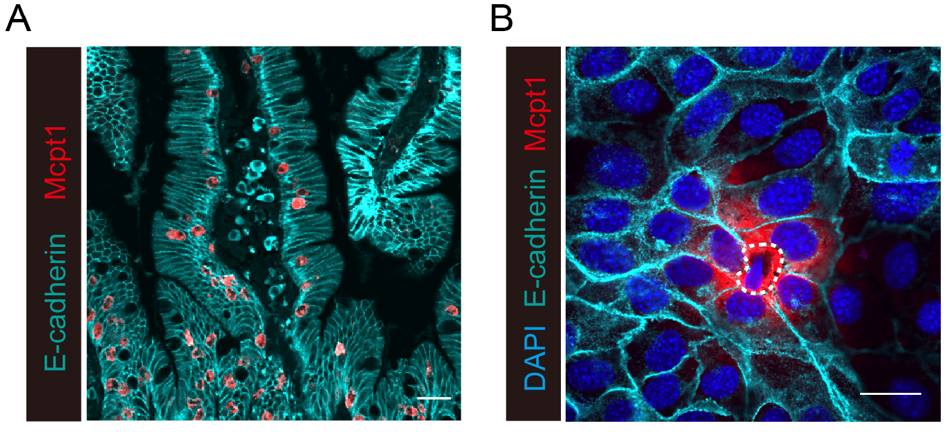
图一 IEMC紧密排列在肠道上皮中,并与上皮细胞相互作用
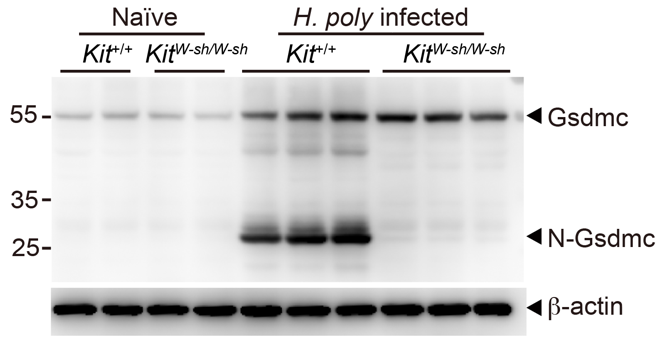
随后的关键问题是IEMC输送到上皮细胞中的物质发挥了怎样的生物学功能。经过费劲摸索,他们发现IEMC可以介导肠道上皮细胞内Gasdermin C(Gsdmc)蛋白的切割激活;在肥大细胞缺失的小鼠中,上皮细胞中的Gsdmc则完全无法被切割(图二)。在具体分子机制的研究中,他们纯化了IEMC中特异性高表达的酶,与Gsdmc蛋白共孵育后发现,Mcpt1可以切割Gsdmc。他们同时使用了Mcpt1敲除小鼠模型,同样也发现Mcpt1缺失部分抑制了Gsdmc的切割。在免疫学功能方面,IEMC介导的Gsdmc激活促使上皮细胞内二型免疫关键细胞因子IL-33释放到胞外,促进ILC2激活,最终加强肠道内的二型免疫反应。这些结果发现了至少一个在体内具有切割Gsdmc活性的蛋白酶,阐述了一种Gsdmc在生理过程中的激活机制。
原文链接:https://doi.org/10.1016/j.immuni.2024.03.017
胡小玉实验室
胡小玉实验室的主要研究领域为髓系细胞在组织微环境中的功能,聚焦巨噬细胞和肥大细胞两类组织驻留髓系亚群。以上介绍的肥大细胞研究延伸出关于起源、功能、治疗等多个独特的研究方向,现课题组招聘多名博士后与助理/副研究员,欢迎感兴趣的小伙伴加入团队一起拓展髓系细胞功能研究的边界。有意向者请将个人简历发送至邮箱:hulab_d311@163.com,邮件标题注明:应聘+具体岗位。
专家点评
Lai Guan Ng 教授
上海交通大学医学院附属仁济医院-上海市免疫治疗创新研究院
Lai Guan Ng教授于2004年在澳大利亚悉尼的Garvan医学研究所获得博士学位后,他加入了新加坡分子与细胞生物学研究所,在林光平教授的指导下进行博士后培训。2006年,Ng博士加入了美国费城威斯塔研究所 Wolfgang Weninger 教授的实验室。在完成博士后培训后,Ng博士于2009年加入新加坡免疫学研究所(SIgN)成为独立研究员。他于2023年开始担任上海免疫治疗研究所高级研究员、系统免疫学中心主任和上海交通大学教授。他的团队的主要研究重点是研究免疫细胞在整个器官背景下如何发挥其功能。Ng博士在免疫学研究领域的贡献在许多重要期刊上发表了多篇文章,如Science、Immunity、Nature Immunology和Journal of Experimental Medicine等。
肥大细胞在机体对抗蠕虫等寄生虫感染和接触过敏原刺激所引起的2型免疫反应中发挥着关键作用。肥大细胞被激活后发生脱颗粒,分泌其胞内储存的多种生物活性介质以此发挥生理功能。根据其在机体内定位分布和功能特征的不同,肥大细胞可分为结缔组织肥大细胞(CTMCs)和黏膜肥大细胞(MMCs)。CTMCs存在于皮肤和腹膜等组织中,对伤口愈合和病原体防御至关重要。MMCs位于呼吸道和胃肠道黏膜,在黏膜免疫反应中扮演重要角色。早在20世纪初,已有研究报道了一种独特的上皮内肥大细胞亚群,然而其发挥的功能作用仍未可知。这类亚群的存在突破了传统意义上肥大细胞的二分类法,更进一步强调了肥大细胞是机体免疫反应复杂调控网络中的重要一环。
来自清华大学胡小玉教授课题组揭示了肠道中的肥大细胞可被归类成 Mcpt1所标记的肠上皮肥大细胞(IEMCs)和另一群位于固有层的Mcpt4标记的肥大细胞 (LPMCs)。随后,作者进一步证明了IEMCs能够定位于上皮层是由α-E整合素介导,并提供了关键证据表明IEMCs在上皮细胞内Gsdmc切割的过程中发挥关键作用。众所周知,gasdermin家族成员能够介导胞膜穿孔并诱发细胞焦亡。而本研究的作者们出乎意料地发现IEMCs虽然促进上皮细胞中的Gsdmc激活,然而该活化并未造成上皮细胞的坏死性死亡、凋亡或焦亡。更为重要的是,IEMCs引起的上皮细胞内Gsdmc活化促使上皮细胞释放IL-33,而IL-33对于介导2型免疫反应和促进肠蠕动十分关键。研究的最后,作者们证明了在机体2型免疫反应中,源自IEMCs的酶,其中包括Mcpt1都参与了上皮细胞Gsdmc的切割。
本研究在肠道微解剖环境中揭示了肥大细胞的异质性,成功鉴定出两个独特亚群,即肠上皮肥大细胞(IEMCs)与固有层肥大细胞(LPMCs)。此次亚群的成功鉴定为肥大细胞多样性的探索奠定了新的理论框架,并显著提升了领域内对肥大细胞在肠道免疫反应中扮演重要角色的认知。此外,本研究强调了在机体稳态及病理条件下深入探讨肥大细胞在不同组织中的定位分布及其免疫功能之间本体关系的重要性。更为重要的是,该研究对肠道内肥大细胞异质性的阐释或能为靶向肥大细胞从而治疗肠道炎症和过敏反应开辟新思路。



