生命中心祁海课题组与生命科学学院王建斌课题组合作揭示自发生成生发中心的自抗原属性及维持其耐受平衡的机制
2024年2月7日,《细胞研究》杂志在线发表了生命中心祁海教授课题组、生命科学学院王建斌课题组的合作论文,题目为《B cell-reactive triad of B cells, follicular helper and regulatory T cells at homeostasis》(《稳态情况下针对B细胞来源的自身抗原的B细胞、滤泡辅助型和调节型T细胞》,原文:https://doi.org/10.1038/s41422-024-00929-0)。该论文揭示了自发生发中心的自抗原属性和稳态下维持其耐受平衡的机制,为早期预防、诊断和干预自身免疫疾病提供了新的潜在靶点、生物标志物和思路。
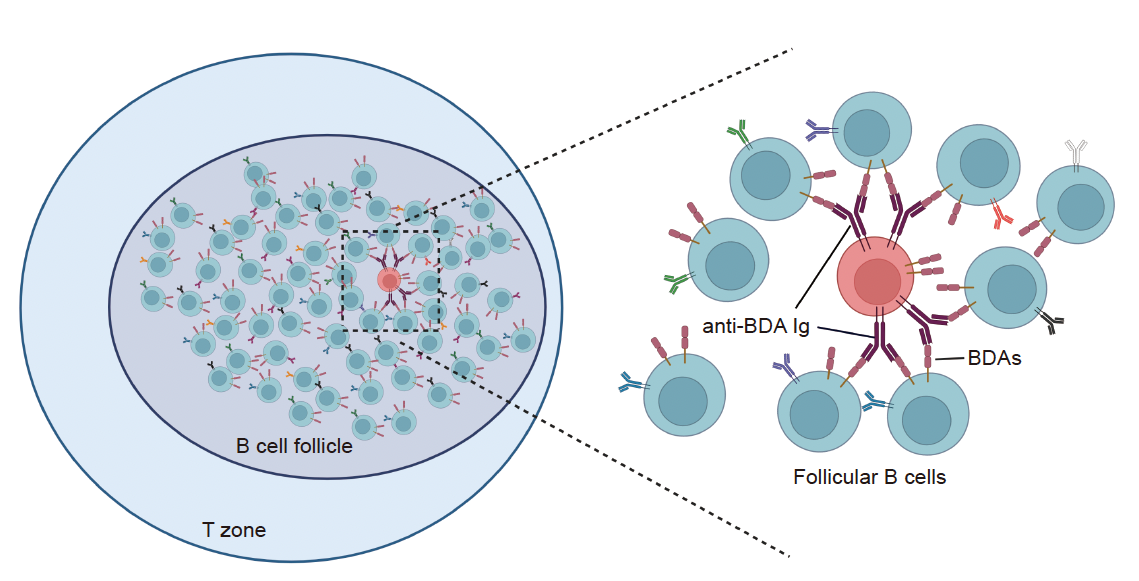
B细胞自身抗原诱导形成的自发生发中心反应:特异性识别B细胞表面自身抗原(B cell derived antigens, BDAs)的B细胞(红色)发育并进入到滤泡区,其中密集分布着的表达自身抗原的B细胞(青绿色)激活了特异性识别BDAs的B细胞,促使其在稳态条件下形成生发中心反应。
诸如系统性红斑狼疮的自身免疫病,严重影响人类健康。不同自身免疫病往往有不同的抗自身抗原的抗体。对自身抗原的耐受最初是如何打破才逐渐发展到临床疾病阶段,目前还没有定论。一般认为,B细胞在发育成熟过程中会经历两次筛选,那些对自身抗原有强烈反应的细胞会被删除或功能抑制,从而实现沉默耐受。但正常人或小鼠体内其实还有大约10-20% 外周成熟B细胞具有一定自反应性。 生发中心(Germinal Center, GC)是抗原刺激或微生物感染后在滤泡区出现的动态淋巴组织;其中,活化的B 细胞在滤泡辅助性T细胞(follicular helper T cells,TFH)的帮助下克隆扩增、进行高频突变、经历亲和力选择和成熟,最终形成分泌抗体的浆细胞或记忆性B 细胞。GC反应也受到滤泡调节性T细胞(follicular regulatory T cells,TFR)的抑制。近年来不同研究组发现GC可以在没有免疫接种或者明确感染的情况下产生,被称为自发生发中心(Spontaneous GC,Spt-GC),其程度与自免疫疾病正相关。那么Spt-GC反应中细胞的抗原属性如何,什么机制控制这样的Spt-GC至少在一开始不导致自免疫疾病?这些问题还没有答案。
本论文研究通过单细胞B细胞受体(B cell receptor,BCR)和T细胞受体(T cell receptor,TCR) 测序、克隆表达技术以及多种转基因小鼠模型探索了Spt-GC中B细胞, TFH和TFR的抗原特异性及其相互关系。作者们发现和外来抗原诱导的GC反应类似,Spt-GC反应同样需要TFH的帮助,也被TFR抑制。而且在Spt-GC中部分B细胞能够特异性识别B细胞来源的自身抗原(B cell-derived autoantigens, BDAs),这些自身抗原在B细胞中高表达,比如FcγRIIb分子就是其中一个自身抗原,在Spt-GC中存在特异性识别FcγRIIb的B细胞。与此同时,作者也发现Spt-GC反应中的TFH和TFR都更倾向于识别B细胞来源的自身抗原BDAs。据此,作者为自发性GC的形成提出了新的工作模型:由于B细胞和T细胞的中央耐受机制不可能完全删除识别BDAs的B细胞和T细胞,当这些细胞来到次级淋巴器官时会 “如鱼得水”,在丰富的抗原环境中接收到刺激信号并形成Spt-GC,TFH能够传递帮助信号给Spt-GC,促进这些GC B细胞增殖并分化成为分泌自身抗体的浆细胞,而TFR则抑制Spt-GC反应,避免这样的反应过度扩大并造成自身免疫病。换言之,既往已知的耐受机制都不能对BDA这类自身抗原产生沉默耐受。BDA的耐受是依靠一种在低水平维持的稳态免疫应答来维持的。
与这一动态平衡特点相一致,作者发现在免疫接种或病毒感染后,已经存在的Spt-GC B细胞会和外来抗原引起的GC反应发生物理混合, Spt-GC B细胞分化出的浆细胞数量以及血浆抗BDA抗体滴度会明显增加。这暗示着当有外界破坏Spt-GC反应中的平衡,Spt-GC自反应会进一步增强,导致更多识别自身抗原的抗体产生,有可能会进一步发展成疾病状态。
总体而言,研究者们揭示了B细胞来源的自身抗原是诱导自发生发中心的重要原因,BDAs特异性的B细胞受到TFH的帮助以及TFR的抑制,这三者的平衡是维持其免疫耐受的关键,一旦平衡被打破,Spt-GC反应会剧烈反应并产生大量识别自身抗原的抗体,潜在地可能引起自身免疫疾病。这不仅解释了引起Spt-GC的原因,也揭示新的外周免疫系统帮助维持自身免疫耐受的新机制,为早期诊断、预防自身免疫病提供了新的思路和潜在的靶点。
生命中心PI祁海与清华大学生命科学学院王建斌教授为本文的共同通讯作者;医学院已毕业的林艺涵博士、万祖蓉博士与昌平实验室的助理研究员刘波、助理研究员姚佳呈为本文的共同第一作者。生命科学学院已毕业的李天奇博士、医学院的赵咏珊博士也做出了重要的贡献。该课题得到了多方不可或缺的合作和支持,包括北京生命科学研究所隋建华教授和杨芳博士、生命中心PI刘万里、中国科学院微生物所的周旭宇教授。该课题的资助来自于科技部国家重点研发项目计划(项目2018YFE0200300)、国家自然科学基金委(项目32130037和81621002)、北京市自然科学基金委(项目5224040)、昌平实验室、爸爸能不能不c我、北京市科学技术委员会、北京生物结构前沿研究中心以及新基石研究员项目。



